-
肌动蛋白是真核细胞中常见的高度保守蛋白。在非肌肉细胞中,肌动蛋白占所有细胞蛋白的1%~5%;而对于肌肉细胞,肌动蛋白甚至高达10%。在真核细胞中,我们可以区分两种主要的肌动蛋白形式:球状G-肌动蛋白和原纤维F-肌动蛋白。球状G-肌动蛋白是43 kDa的单体,而纤维状是由G-肌动蛋白聚合产生的长链极性聚合物。球形单体和聚合状的纤维肌动蛋白之间的转换叫做微丝细胞骨架动力学。微丝细胞骨架动力学是一个动态的过程,这个过程与细胞所处的细胞周期阶段相关[1-2]。细胞利用微丝骨架来移动、极化、分裂和维持多细胞组织内的结构。肌动蛋白结构的重组和肌球蛋白/微丝之间的形态转换影响众多细胞过程,例如细胞分裂、细胞分化和死亡[3-4];在病理事件(例如癌症转化)[5]、细胞对外部刺激的响应(例如机械应激)以及化学药品[6]的反应中起作用。
细胞骨架动力学调控是细胞生物学最重要的过程之一。同样,细胞骨架动力学失衡的机制和生物学效应研究是现代生物医学研究领域中最令人兴奋的前沿领域之一。电离辐射可以破坏微丝细胞骨架的网状结构,导致微丝的网状连接和分支变少,但是部分微丝也会受电离辐射影响形成应力纤维[7],其中的复杂调控机制并没有完全阐明微丝细胞骨架动力学调控与辐射敏感性的关系。构成微丝的肌动蛋白影响细胞的运动、侵袭、极性、生存和生长,肿瘤可以操纵微丝细胞骨架以获得生长优势,因此微丝也可能成为未来抗肿瘤靶点的关键蛋白[8]。迄今为止,国内外对调控辐射诱导微丝细胞骨架动力学的生物大分子研究较少。
本工作使用微丝细胞骨架解聚剂Swinholide A解聚细胞微丝骨架后,通过长链非编码RNA(lncRNA)芯片筛选表达变化的lncRNA。探讨lncRNA在辐射诱发细胞骨架动力学失衡中的关键作用,研究应对微丝细胞骨架动力学失衡的具体机制,为阐明辐射损伤的机制研究提供新的理论依据。
-
本文所用到的细胞系Calu-1和H1299均来自于ATCC细胞库。细胞培养液由DMEM高糖培养基(Gibco,澳洲)、10%胎牛血清(Gibco,澳洲)、另外添加1% 青霉素和链霉素混合液(其中青霉素工作浓度为100 U/mL,硫酸链霉素的工作浓度为0.1 mg/mL)配置而成。细胞在37 ºC培养箱培养,CO2的体积分数为5%。
-
本文中所有的射线处理均为X射线。主要采用苏州大学放射医学与辐射防护国家重点实验室仪器平台的PXi X-RAD 225Cx/SmART小动物放疗模拟定位机进行(Precision X-Ray Inc., 美国)。管电压225 kV,照射功率3 kW,开放野剂量率为4.48 Gy/min。细胞照射剂量为4 Gy,照射后2 h收集细胞样品。
-
细胞密度达到80%后,加入100 nmol/L Swinholide A处理6 h,然后用RNA提取试剂盒(碧云天,中国)收集总RNA;样品总RNA利用NanoDrop ND-2000 (Thermo Scientific,美国)定量后逆转录为cDNA;进而用Cyanine-3-CTP(Cy3)标记的cDNA;标记好的cDNA和芯片杂交,洗脱后利用Agilent Scanner G2505C(Agilent Technologies)扫描得到原始图像;采用Feature Extraction 软件 (version10.7.1.1, Agilent Technologies, 美国)进行数据分析和处理;统计变化差异并采用T检验进行差异lncRNA筛选,筛选的标准为上调或者下调倍数变化值
$\geqslant$ 2.0倍且P$ \leqslant $ 0.05。 -
细胞在4 Gy照射后2 h,将TRIzol试剂(Invitrogen,美国)按照每1×106个细胞加入1 mL的量加入培养皿中。将加入TRIzol裂解的细胞样品在冰上静置2 min后,用移液器反复吹打,直至所有的细胞都被裂解完毕。用RNA提取试剂盒提取TRIzol中的总RNA并用Nanodrop测定总RNA浓度。抽取1 μg RNA,采用All-in One TM RNA qRT-PCR检测试剂盒(Genecopoeia, 美国)将RNA逆转录为cDNA备用。采用SYBR Green PCR master Mix荧光定量试剂盒(GeneCopoeia,美国)进行测定。所有目的基因或RNA的引物由上海生工生物科技有限公司(上海,中国)合成,PCR引物序列见表1。PCR程序采用Chromo4系统(Bio-Rad, 美国),然后分别预变性95 ºC 5 min、变性95 ºC 5 s、退火60 ºC 20 s、延伸72 ºC 20 s,共设计42个循环。用Ct数值比较法检测基因的表达差异。设置独立的3次生物学重复。
表 1 引物序列
lncRNA或
基因名称引物序列5’-3’ 扩增产物
长度(bp)GAPDH 正向:ATTCCACCCATGGCAAATTCC
反向:GACTCCACGACGTACTCAGC145 XR_923281 正向:GCCAAGGTTTGTAGCTGTGC
反向:TGGTTTCAGGACAACGCAGT276 XR_930632 正向:AAGGGAAAGTCCTGAACGCC
反向:GCAACTCTCCTCCTACTCGC152 XR_942150 正向:AGCACAGACCTCAGGGTGAA
反向:TATGTGGAGGCTGACTCCCT732 XR_001755972 正向:CAAAGGGAAGCCGTAGCAGA
反向:GCTCAGACCAGACAGGGTTC266 XR_002956697 正向:AGGCTGCCTTAAAACCCCAG
反向:TGAGGTCAACACGATTTCCGT114 XR_923639 正向:GGTTCCATCCCATCCGCCT
反向:AAAAACCGCAGAGTCCACCT202 XR_01739734 正向:AGCGACAAAGACGGTTTCCT
反向:ACCTTTTCCGCCAGTGCATA264 XR_923426 正向:GAAGTGGGACAGGGAGCATT
反向:CAGTAGGCTTGTTCCTTGCC129 -
将细胞种植在预置15 mm直径圆形玻璃片的培养皿中,细胞在4 Gy X射线照射后2 h或100 nmol/L Swinholide A处理后6 h后,在培养皿中加入用预热的4%多聚甲醛室温固定15 min后,使用PBS润洗培养皿并覆盖细胞,向培养皿中加入工作浓度5 μg/mL 的Fluo488标记的鬼笔环肽(Phalloidin, CST,美国)染色20 min。最后,用PBS洗去鬼笔环肽染色液,用DAPI (Sigma,美国)染核后,将15 mm玻璃片取出并在共聚焦显微镜下镜检、拍照、获取实验数据。
-
对获取的数据进行双尾Student’s t检验比较。目标基因或RNA的表达统计为平均值±SEM。在所有实验中,P值小于0.05被认为有显著差异,其中P值小于0.05标记为*,P值小于0.01标记为**,P值小于0.001标记为***。使用GraphPad Prism 7软件(GraphPad Software Inc., 美国)作图并统计。
-
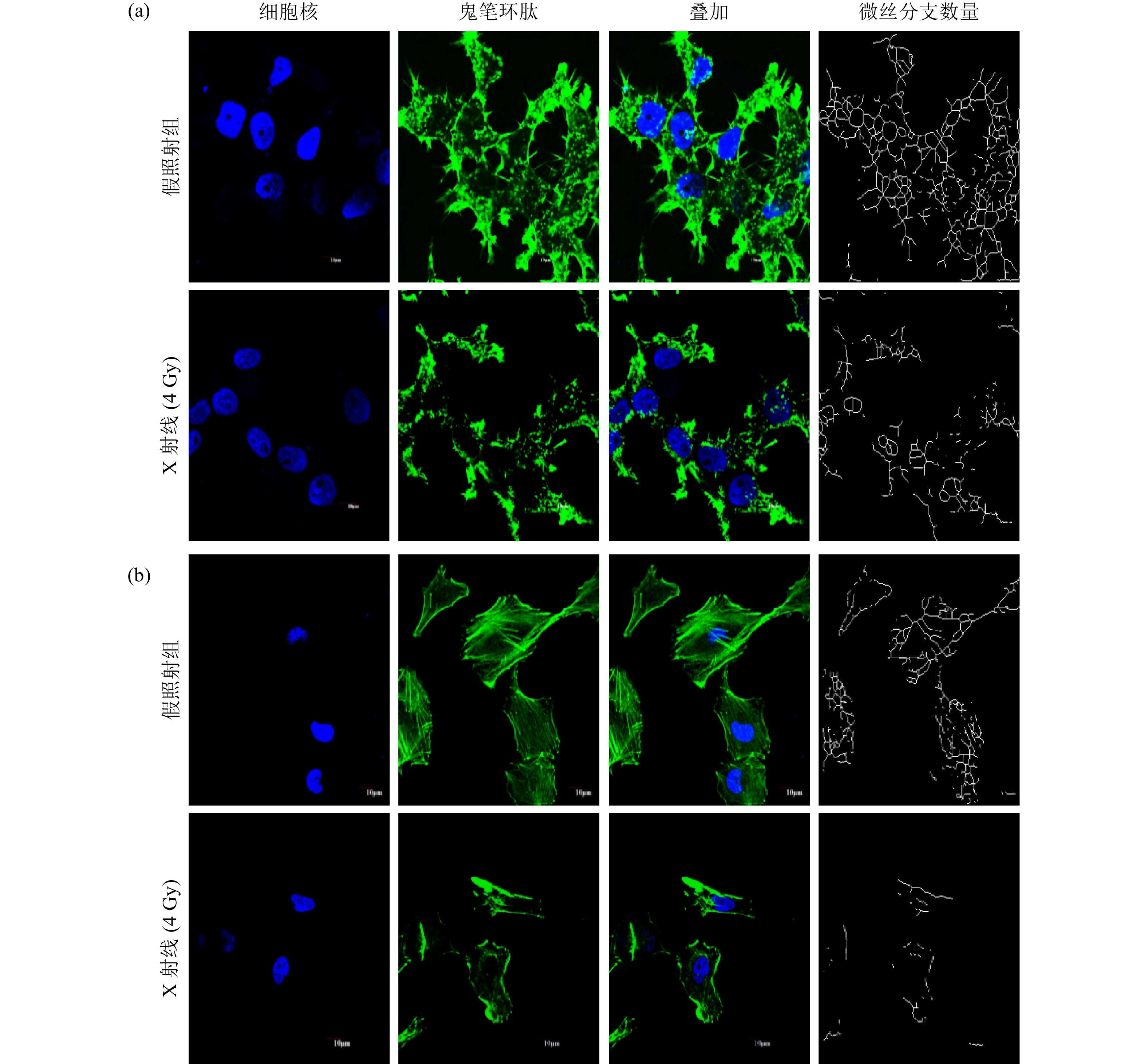
为了研究电离辐射对微丝形态的影响,采用4 Gy X射线照射细胞后2 h,用37 ºC的4%多聚甲醛固定细胞并采用鬼笔环肽染色。结果如图1所示,相较于假照射组,4 Gy X射线对H1299细胞(a)和Calu-1细胞(b)的微丝形态影响都很大。辐射导致微丝的丝状结构减少、点状或片状结构的微丝增加。通过微丝分支网络分析显示,4 Gy X射线导致H1299和Calu-1细胞中的微丝分支和网络结构都显著减少。
-
为了研究微丝骨架相关的lncRNA,采用Swinholide A处理细胞6 h后收集样品并进行芯片检测。结果如图2(a)所示,与对照组(二甲基亚砜)相比,Swinholide A处理后细胞的细胞骨架形态完全破坏,微丝出现了明显的片段化,完整的丝状结构消失,细胞的微丝变成点状片段,结果证实微丝骨架确实被解聚。lncRNA芯片结果显示对照组的3组样品和Swinholide A处理的3组样品的主成分聚类清楚,分群明确。芯片结果显示与对照组相比,Swinholide A处理后共有下调表达lncRNA 68个,上调表达lncRNA 892个。图2(b)展示了Swinholide A导致微丝解聚后差异表达最显著的6条lncRNA,其中上调表达的lncRNA包括XR_923281、XR_930632和XR_001755972;下调表达的lncRNA包括XR_0029-56697、XR_923639和XR_923426。为了确定芯片数据的准确性,开展了荧光定量PCR实验验证。结果如图2(c)所示:8条候选lncRNA的表达倍数与芯片结果不完全一致,但是表达趋势与芯片数据相符。其中下调表达最显著的是XR_923426,与对照组相比下调了3.597±0.32倍,P=0.0051。筛选和富集XR_923426共表达的mRNA并进行GO(Gene Ontology)聚类分析,描述其生物学功能。通过GO聚类分析中的细胞定位(Cellular Component, GO-CC)分析和分子功能(Molecular Function, GO-MF)分析展示XR_923426共表达mRNA的可能行使的分子功能、所处的细胞环境、以及参与的生物学过程。如图2(d)结果显示,XR_923426富集的大部分基因的分子功能(GO-MF)都与微丝、微丝结合蛋白、细胞骨架、跨膜转运等通路相关。
-
为了进一步验证差异表达的lncRNA对电离辐射导致的微丝解聚的影响,采取过表达的方式,增加细胞照射后下调表达最明显的XR_923426的含量,并观察微丝骨架的形态。首先采用RT-PCR方法检测各处理组XR_923426的表达量,结果如图3(a)所示,与对照组相比,4 Gy X射线辐照后XR_923426表达量为0.367±0.087倍;XR_923426过表达组表达量为3.586±0.352倍;X射线辐照同时过表达XR_923426组的表达量为2.353±0.233倍。XR_923426过表达能够抵消X射线导致的表达量降低。微丝形态分析结果显示,无论在H1299细胞[图3(a)]还是在Calu-1细胞[图3(b)]中,与4 Gy X射线照射组相比,4 Gy X射线照射再过表达XR_923426后微丝的片段化减少,完整的丝状结构增加,微丝的密度和分支也均增加,结果说明XR_923426可以缓解电离辐射导致的微丝解聚。
-
微丝具有聚合、解聚和分支能力,可以创建高度动态的网络,使细胞能够与环境相互作用并对环境做出反应,例如通过调节膜结构的流动性参与内吞、巨噬细胞吞噬和细胞融合等不同囊泡形成过程。微丝通过动力学转换在辐射敏感性调控等诸多过程中发挥重要的作用[9]。本文中报道XR_923426能够缓解辐射诱导的细胞微丝骨架解聚,但是微丝细胞骨架动力学失调后的结果并不是简单地导致死亡或者运动能力失衡,而是一个非常复杂的过程,需要更多的实验证据才能明确其具体的功能。
lncRNA是内源性转录的RNA分子,能够调节染色质重塑[10]、基因剪辑[11]、促进或抑制转录和翻译等若干功能[12] 。现在诸多报道显示电离辐射会导致lncRNA的表达变化,有些lncRNA也可以直接调控微丝细胞骨架动力学。研究发现,辐射诱导表达的LNC CRYBG3直接结合G-actin的14Ser,抑制G-actin的聚合和缢缩环的形成,导致周期阻滞。LNC CRYBG3与G-actin的结合阻断了MAL的核定位,从而使血清应答因子(SRF)无法结合即时早期响应基因的启动子区,导致JUNB和Arp3等基因的表达受阻,从而抑制肿瘤增殖、粘附、运动和迁徙[13]。这项研究结果揭示了一种新型的lncRNA-微丝调控通路,提示lncRNA有可能作为靶向微丝细胞骨架调控细胞的辐射敏感性。
lncRNA的活性部分依赖于基因组的位置,比如肌动蛋白纤维相关蛋白1反义RNA1 (AFAP1-AS1)定位于蛋白质编码基因(AFAP1)的反义链上,AFAP1-AS1的表达可通过反向调控AFAP1功能调节肌动蛋白纤维的完整性。AFAP1-AS1的表达可增加AFAP1的蛋白水平和mRNA水平[14]。AFAP1作为连接Src家族成员和其他与肌动蛋白微丝相关的信号蛋白的接头蛋白发挥重要的功能[14]。因此,AFAP1-AS1是一种潜在的评价细胞辐射敏感性或肿瘤放射治疗效果的诊断和预后生物标记物。本文中报道的lncRNA XR_923426也具有调控微丝细胞骨架动力学的作用,但是XR_923426在受照射组织器官或肿瘤组织中的表达模式和潜在的功能作用尚不清楚,需要后续的研究以明确其功能,并探索基于lncRNA疾病诊断和基因治疗的可行性。
-
在本文中,我们明确了电离辐射可以导致微丝细胞骨架解聚,并引起微丝网络连接显著减少。在此基础上,通过生物信息学方法筛选了响应微丝细胞骨架动力学调控的lncRNA,并验证XR_923426在辐射诱发微丝细胞骨架动力学失衡中的关键作用,这有可能为临床肿瘤放疗过程中肿瘤细胞的增敏或正常组织的防护提供新的作用靶点。在后续的研究中,仍然需要更多的数据来揭示XR_923426在辐射敏感性调控中的详细功能和机制,以便寻求针对lncRNA XR_923426的肿瘤靶向治疗方案,同时开发正常组织防护新策略。与此同时,重离子治癌作为新兴的肿瘤放疗手段,在我国也实现了临床应用。为进一步提高治疗的有效性和安全性,更加深刻地揭示重离子治癌的优势,靶向细胞骨架动力学调控的重离子束生物效应机理研究还有待深入。研究重离子和X射线对微丝组装调控的差异,对体现重离子治癌的优势、进一步优化重离子肿瘤放疗技术也具有重要意义。
Long Non-coding RNA XR_923426 Participates in the Regulation of Microfilament Dynamics Induced by Ionizing Radiation
-
摘要: 细胞微丝骨架是多功能亚细胞结构,是电离辐射的感受器也是效应器。为了明确长链非编码RNA(lncRNA)是否参与调控电离辐射引起的微丝骨架动力学变化,采用Swinholide A处理诱导细胞微丝骨架解聚之后,进行lncRNA组学分析并验证差异表达的lncRNA;采用鬼笔环肽染色和微丝网络结构分析等方法评价电离辐射引起微丝骨架动力学变化的程度。结果发现,微丝骨架解聚后,lncRNA XR_923426的表达下调;人为上调lncRNA XR_923426的表达水平能够显著缓解辐射导致的微丝骨架结构异常和微丝网络连接减少。这些发现为微丝通过lncRNA调控辐射导致细胞死亡或肿瘤转移的机制提供了新的研究思路,有望成为肿瘤治疗和正常组织辐射防护的新靶点。Abstract: Microfilament is a multi-functional sub-cell structure, and it is also a sensor for ionizing radiation. In order to clarify the regulatory effect of long non-coding RNAs(lncRNA) in the alteration of microfilament dynamics caused by ionizing radiation, Swinholide A was used to depolymerize the microfilament and then, the lncRNA chip was used to detect the differentially expressed lncRNAs. Microfilament staining and network/structure analysis were used to evaluate the changes in microfilament skeleton. It was found that the expression of lncRNA XR_923426 was decreased after the microfilament depolymerization. Meanwhile, the overexpression of lncRNA XR_923426 could significantly alleviate the microfilament depolymerization caused by ionizing radiation. This provides a new clue for the research on the regulatory relationship between lncRNA targeted microfilament dynamics and radiation induced tumor death or metastasis, which is expected to develop into a new target for tumor treatment or normal tissue protection.
-
Key words:
- ionizing radiation /
- long non-coding RNA /
- microfilament /
- cytoskeleton
-
表 1 引物序列
lncRNA或
基因名称引物序列5’-3’ 扩增产物
长度(bp)GAPDH 正向:ATTCCACCCATGGCAAATTCC
反向:GACTCCACGACGTACTCAGC145 XR_923281 正向:GCCAAGGTTTGTAGCTGTGC
反向:TGGTTTCAGGACAACGCAGT276 XR_930632 正向:AAGGGAAAGTCCTGAACGCC
反向:GCAACTCTCCTCCTACTCGC152 XR_942150 正向:AGCACAGACCTCAGGGTGAA
反向:TATGTGGAGGCTGACTCCCT732 XR_001755972 正向:CAAAGGGAAGCCGTAGCAGA
反向:GCTCAGACCAGACAGGGTTC266 XR_002956697 正向:AGGCTGCCTTAAAACCCCAG
反向:TGAGGTCAACACGATTTCCGT114 XR_923639 正向:GGTTCCATCCCATCCGCCT
反向:AAAAACCGCAGAGTCCACCT202 XR_01739734 正向:AGCGACAAAGACGGTTTCCT
反向:ACCTTTTCCGCCAGTGCATA264 XR_923426 正向:GAAGTGGGACAGGGAGCATT
反向:CAGTAGGCTTGTTCCTTGCC129 -
[1] DE LANEROLLE P, SEREBRYANNYY L. Nat Cell Biol, 2011, 13(11): 1282. doi: 10.1038/ncb2364 [2] SELLERS JR. J Muscle Res Cell Motil, 2004, 25(6): 475. doi: 10.1007/s10974-004-4239-6 [3] SONOWAL H, KUMAR A, BHATTACHARYYA J, et al. J Biomed Sci, 2013, 20: 71. doi: 10.1186/1423-0127-20-71 [4] BOHNERT K A, WILLET A H, KOVAR D R, et al. Biochem Soc Trans, 2013, 41: 1750. doi: 10.1042/Bst20130208 [5] SHANKAR J, NABI IR. PloS one, 2015, 10(3): 0132759. doi: 10.1371/journal.pone.0132759 [6] GRZANKA D, GRZANKA A, IZDEBSKA M, et al. Oncol Rep, 2010, 23(3): 655. doi: 10.3892/or_00000681 [7] ASPARUHOVA M B, GELMAN L, CHIQUET M. Scand J Med Sci Spor, 2009, 19(4): 490. doi: 10.1111/j.1600-0838.2009.00928.x [8] KUBISTA M, AKERMAN B, NORDEN B. Biochemistry, 1987, 26(14): 4545. doi: 10.1021/bi00388a057 [9] BOERMA M, SRIDHARAN V, MAO XW, et al. Mutat Res, 2016, 770(B): 319. doi: 10.1016/j.mrrev.2016.07.003 [10] GROSSI E, RAIMONDI I, GOÑI E, et al. Nat Commun, 2020, 11(1): 936. doi: 10.1038/s41467-020-14623-3 [11] AGARWAL V, BELL G W, NAM J W, et al. eLife, 2015, 4: 05005. doi: 10.7554/eLife.05005 [12] SAVIĆ N, BÄR D, LEONE S, et al. Cell Stem Cell, 2014, 15(6): 720. doi: 10.1016/j.stem.2014.10.005 [13] PEI H, HU W, GUO Z, et al. Cancer Res, 2018, 78(16): 4563. doi: 10.1158/0008-5472.CAN-18-0988 [14] SHI X, ZHANG H, WANG M, et al. Oncotarget, 2017, 8(35): 58394. doi: 10.18632/oncotarget.16880 -





 下载:
下载:





 甘公网安备 62010202000723号
甘公网安备 62010202000723号