-
纤维素(Cellulose)是自然界中最丰富的碳水化合物,它是由D-葡萄糖以
$\beta $ -1, 4糖苷键连接成的大分子多糖,是形成植物细胞壁的主要结构成分[1]。由于纤维素中存在结晶区,结构更加致密,它比其它植物细胞壁多糖更难被酶降解。真菌中降解纤维素的水解酶包括三类:$\beta $ -1, 4-内切葡聚糖酶(EC3.2.1.4,简称EG)、外切葡聚糖酶(EC3.2.1.91,简称CHB)和$\beta $ -葡萄糖苷酶(EC3.2.1.21,简称BGL)[2-3]。真菌生产的纤维素酶产量高、活性大,故在畜牧业和饲料工业中应用的纤维素酶主要来源为真菌生产[4-6]。研究人员针对来自多种真菌的纤维素酶的生产和优化进行了相关的研究。黑曲霉在工业生物技术生产中被广泛应用,其主要用于生产淀粉酶、酸性蛋白酶、纤维素酶、果胶酶、葡萄糖氧化酶、柠檬酸、葡糖酸和没食子酸等,具有重要的经济价值和研究意义[7-8]。黑曲霉作为一种众所周知的遗传可控的工业真菌,能快速降解植物细胞壁多糖,是生产纤维素酶的最佳选择菌[9]。目前选育优良菌株的方法主要有基因工程育种和诱变育种。与基因工程育种相比,诱变育种较为高效、简单且快速[10]。常用的诱变育种主要有物理、化学以及生物诱变。Liu等[11]通过紫外线诱变草酸青霉菌JU-A10得到了一株高产纤维素酶的菌株,FPA酶活最高达到了15.4 FPU/mL。Raghuwanshi 等[12]采用紫外线诱变棘孢木霉RCK2011的方法进行提高纤维素酶活性的诱变选育研究,筛选并获得了突变菌株 SR1-7,FPA和CMC酶活最高分别达到了2.2 和13.2 IU/g。Dong等[13]对烟曲霉野生菌株进行重离子束诱变处理,最终获得的突变菌株FPA和CMC酶活分别达到了1.81 和1.11 IU/mL。Tang等[14]利用重离子辐照诱变选育的纤维素酶生产菌株FPA、CMC酶活分别达到了61.3、116.2 U/mL。由于重离子束在育种工作中有着独特的物理和生物学优势,现在受到越来越多育种工作者的青睐[15]。微生物具备能够迅速适应各种环境条件的能力,这种突出特性已被应用于改造各种属类的菌株,以适应不同的生物技术应用。适应性实验室进化(ALE)是在实验室中模拟自然进化的变异和选择过程,通过人工给予一定生长压力,实现菌株的定向进化,从进化群体中筛选出优良菌株的一种方法[16]。模式生物构巢曲霉(Aspergillus nidulans)通过适应性实验室进化,在生物适应性和表型可塑性方面,表现出了种群的更高适应性[17-18]。Sun等[19]通过对微藻裂殖菌高盐驯化实验,得到了细胞干重和脂质产量均显著提高的优良突变株。Kulkarni等[20]通过ALE提高了嗜酸乳杆菌在高温下的存活率。
随着诱变技术的发展,单一的诱变处理由于存在突变率低、诱变效率有限等问题逐渐被复合诱变的方式取代[21]。至今,重离子束诱变结合适应性实验室进化的应用研究还未见报道。所以本研究依托兰州重离子加速器国家实验室平台,开展重离子束12C6+辐照诱变选育黑曲霉并对其突变体进行适应性实验室进化实验,探讨重离子辐照结合适应性进化的定向性技术对于提高黑曲霉突变体真菌纤维素酶活力的影响,以期得到稳定的高产纤维素酶、高酶活性的突变菌株,从而降低生产成本,有利于工业生产。
-
实验菌株黑曲霉(Aspergillus niger),由中国科学院近代物理研究所生物物理研究室提供。
PDA培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,蒸馏水1 000 mL,自然pH。
刚果红培养基:NaNO3 1.0 g/L,Na2HPO4 1.2 g/L,KH2PO4 0.9 g/L,MgSO4 0.5 g/L,KCl 0.5 g/L,酵母浸出粉0.5 g/L,酸水解酪蛋白0.5 g/L,刚果红0.2 g/L,纤维素粉5.0 g/L,琼脂15.0 g/L,pH=7.0。
固体培养基:NaNO3 6.0 g/L,KH2PO4 3.6 g/L,KCl 1.2 g/L,MgSO4 1.2 g/L,10 mL微量元素(EDTA 10 g/L,ZnSO4·7H2O 4.4 g/L,MnCl2·4H2O 1.01 g/L,CuSO4·5H2O 0.315 g/L,(NH4)6Mo7O24·4H2O 0.22 g/L,CaCl2·2H2O 1.47 g/L,FeSO4·7H2O 1.0 g/L),胰蛋白胨2 g/L,䏡蛋白胨2 g/L,酵母提取物2 g/L,琼脂20 g/L,葡萄糖15 g/L,D-葡萄糖15 g/L,pH=6.5。
复筛培养基(分A、B两个配方):A配方培养基为NaNO3 6.0 g/L,KH2PO4 3.6 g/L,KCl 1.2 g/L,MgSO4 1.2 g/L,10 mL 微量元素(EDTA 10 g/L,ZnSO4 ·7H2O 4.4 g/L,MnCl2·4H2O 1.01 g/L,CuSO4·5H2O 0.315 g/L,(NH4)6Mo7O24·4H2O 0.22 g/L,CaCl2·2H2O 1.47 g/L,FeSO4·7H2O 1.0 g/L),胰蛋白胨2 g/L,䏡蛋白胨2 g/L,酵母提取物2 g/L,琼脂20 g/L,α-纤维素 5 g/L(第一次0.5%,以后每一次加0.1%)。B配方培养基另外加:葡萄糖15 g/L,pH=6.5。
发酵培养基:NaNO3 12.0 g/L,KH2PO4 3.0 g/L,KCl 1.0 g/L,MgSO4 1.0 g/L,10 mL微量元素(EDTA 10 g/L,ZnSO4·7H2O 4.4 g/L,MnCl2·4H2O 1.01 g/L,CuSO4·5H2O 0.315 g/L,(NH4)6Mo7O24·4H2O 0.22 g/L,CaCl2·2H2O 1.47 g/L,FeSO4·7H2O 1.0 g/L),葡萄糖10 g/L,D-葡萄糖10 g/L,吐温−80 10 mL,L-谷氨酸钠0.6 g/L,胰蛋白胨 4 g/L,酵母提取物2 g/L,酪蛋白氨基酸2 g/L,酵母RNA 0.2 g/L,pH=5.8。
以上培养基均需在121 °C下灭菌20 min。
-
取培养5 d成熟的黑曲霉平板,每个平板加3~4 mL无菌水洗下原始菌株的孢子,吸取孢子液于装有脱脂棉漏斗过滤后取菌悬液1 mL封装于35 mm辐照皿中,每个剂量两个平行,利用兰州重离子加速器国家实验室提供的能量为80 MeV/u的重离子束12C6+,按照0 , 40 , 70 , 100 , 130 , 160, 190 Gy的辐照剂量进行辐照。
-
将辐照后的菌悬液分别稀释到一定倍数后涂布平板,待菌体长出后统计菌落数并计算致死率,具体计算公式如下:
$$\begin{split} 致死率(\text{%})= &\big[(辐照前活菌数-辐照后活菌数)/ \\&辐照前活菌数\big]×100\text{%}。 \end{split} $$ -
黑曲霉通过重离子束辐照诱变后,通过不同能量离子束诱变处理后的菌液,稀释至10−3、10−3.5、10−4浓度梯度后分别吸取0.1 mL到刚果红固体培养基平板上均匀涂布,封口膜封口倒置于恒温培养箱中30 °C培养,培养2 d后挑取在刚果红平板上透明圈明显的菌落,转接至PDA固体平板培养5 d,不同辐照剂量分设3组平行,用游标卡尺测量透明圈及菌落直径并计算各菌落的HC值(透明圈直径/菌落直径),挑取高于对照组20%以上的优良菌株。
-
选取平板初筛的优良菌株,在精筛谱系实验中,按复筛培养基中的A、B配方形成2种谱系,分别接种于上述2种谱系中[22]。每个谱系培养5 d后,用无菌水洗下并收集完整的孢子,充分混合A、B配方的孢子悬浮液,再将其分别接种于2种谱系中,连续进行8周培养后可以观察到,黑曲霉在α-纤维素谱系上生长良好,菌株的适应性逐渐增强。收集在α-纤维素上生长最好的纯化单菌落保藏进行下一步研究。
-
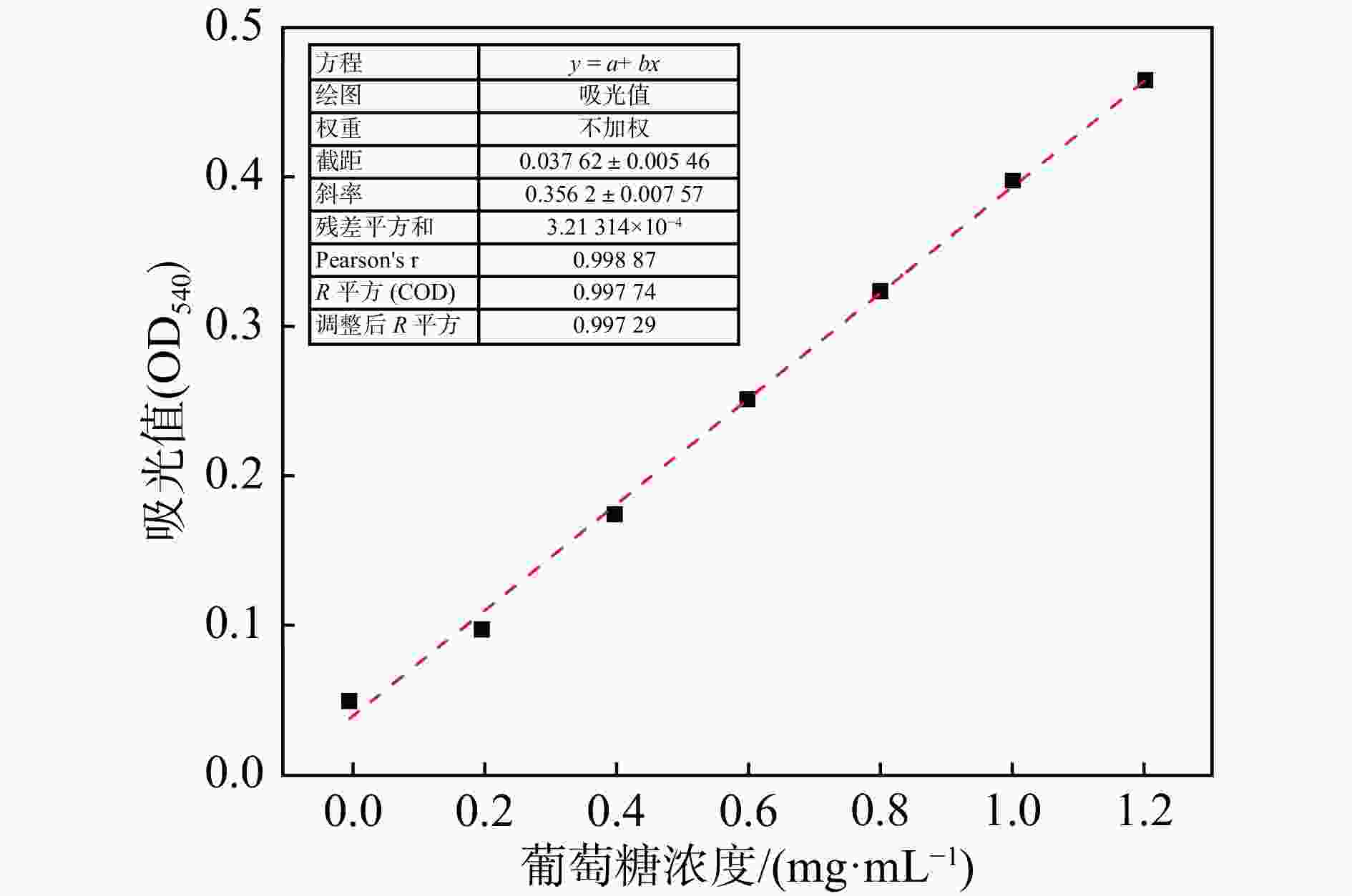
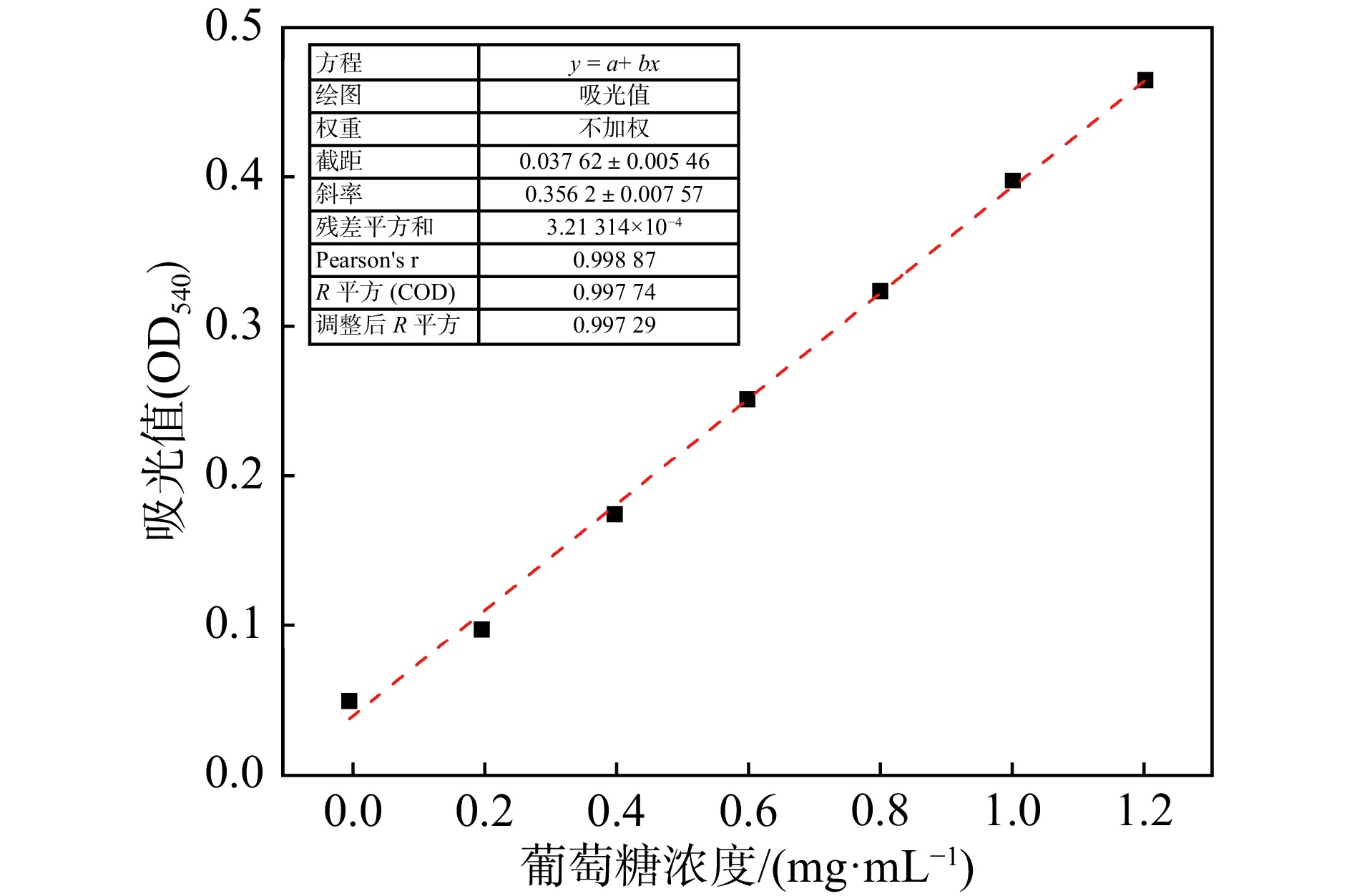
将葡萄糖烘干至恒重,然后配制1 mg/mL的葡萄糖标准溶液,分别吸取0, 0.2, 0.4, 0.6, 0.8, 1.0, 1.2 mL葡萄糖标准溶液于25 mL具塞刻度试管中,接着用pH= 4.8的柠檬酸-柠檬酸钠缓冲液定容至2 mL,配制成不同浓度梯度的葡萄糖溶液。各试管中再加入3 mL DNS显色剂,摇匀后在沸水浴中加热5 min,取出自然冷却,用蒸馏水定容至25 mL,摇匀后吸取200 μL加入到96孔板中,于540 nm波长下测定其吸光度。以吸光度值为纵坐标,以葡萄糖含量为横坐标,绘制标准曲线,得到的标准曲线方程为y=0.356 2x+0.037 62 (R2=0.997 74),线性相关性良好,见图1,表明可以通过该方程计算酶反应中的葡萄糖含量,从而计算纤维素酶活性。
-
取培养5 d成熟的黑曲霉平板,每个平板加5 mL无菌水,用涂布棒洗下原始菌株的孢子,再用150目灭菌后的不锈钢过滤筛过滤得到孢子液,按5%的接种量接种至100 mL发酵培养基中,在温度30 °C和转速180 r/min的条件下发酵,每隔24 h进行取样,将取得的发酵液在4 °C、4 000 r/min条件下离心10 min,得到粗酶液,然后参照DNS法测定各株菌产生的滤纸酶活(FPA)[23-24]和内切葡聚糖酶(CMCase)[25]的活性。滤纸酶活操作步骤为:25 mL带塞试管底部放入折叠好的1 cm × 6 cm的滤纸条,加入1.5 mL pH 4.8的柠檬酸-柠檬酸钠缓冲液,让滤纸条完整浸入缓冲液中,再加入0.5 mL粗酶液(对照组在反应结束冷却后、定容之前再添加0.5 mL粗酶液),混匀后50 °C水浴条件下反应60 min。水浴加热结束后加3.0 mL DNS试剂并摇匀,沸水浴中反应5 min,冷却后定容至25 mL,摇匀后用酶标仪检测在540 nm下的吸光度。根据葡萄糖标准曲线计算葡萄糖含量(实验组的葡萄糖含量减去对照组的葡萄糖含量即为反应生成的葡萄糖含量),再根据下面公式计算酶活力。内切葡聚糖酶活的操作步骤:滤纸酶活的操作中的缓冲液换成羧甲基纤维素钠、50 °C水浴条件下反应60 min换成30 min,其余条件不变。
酶活单位定义(U/mL):在一定温度(一般为室温)条件下,每分钟内反应水解底物生成的每微克葡萄糖所需要消耗的酶量定义为1个酶活单位(U)。酶活力计算公式[26]:
$$ 酶活力({\rm{U}}/{\rm{mL}})= \frac{{M}\times {D}\times{1\;000}}{T\times V} \text{,} $$ 式中:M为还原糖浓度(mg/mL);D为粗酶液的稀释倍数;T为反应时间(min);V为添加的粗酶液体积(mL)。
-
采用江苏酶免集团的纤维素酶(CE)酶联免疫分析试剂盒进行发酵培养基中粗酶液(粗酶液的制备:发酵液在4 °C、4 000 r/min条件下离心10 min所得上清液)纤维素酶含量的测定。试剂盒应用双抗体夹心法测定突变菌株CJH-JWSFZh-W122在不同时段中纤维素酶水平。用纯化的纤维素酶(CE)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入纤维素酶(CE),再与HRP标记的纤维素酶(CE)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。TMB在HRP酶的催化下溶液颜色转化成蓝色,并在酸的作用下转化成最终的黄色,溶液颜色的深浅和样品中纤维素酶(CE)的含量呈正相关。用酶标仪测定在450 nm波长下的吸光度,根据标准曲线计算纤维素酶含量。
-
DNA制备:使用天根生化科技公司的真菌提取试剂盒进行DNA提取。RAPD-PCR反应引物如表1;PCR反应总体积为20 μL,其中10×PCR Buffer 2 μL;MgCl2 1.4 μL;引物0.8 μL;dNTPs1.6 μL;Taq 酶(5U/μL)0.1 μL;模板DNA(50 μg/mL)0.5 μL;ddH2O 13.6 μL。PCR 反应程序为95 °C预变性5 min,94 °C变性45 s,36 °C复性45 s,72 °C延伸90 s,30个循环后,72 °C延伸10 min,4 °C保存。每次PCR 反应均设不含模板DNA 的空白对照(水)。扩增产物以2%琼脂糖凝胶电泳分离,溴化乙锭染色,在BioRad2 Gel2700 TM 凝胶成像系统下观察并拍照记录。
表 1 RAPD-PCR反应引物
编号 RAPD
引物编号5′-序列-3′编号 编号 RAPD
引物编号5′-序列-3′编号 1 S65 GATGACCGCC 11 S212 GGGTGTGTAG 2 S66 GAACGGACTC 12 S25 AGGGGTCTTG 3 S2160 CACCGACATC 13 S177 GGTGGTGATG 4 S2010 GGACGTTGAG 14 S1103 CTTCCCTGTG 5 S10 CTGCTGGGAC 15 S1121 ACTCCACGTC 6 S1404 GGCACGCGTT 16 S1125 GGGTGCAGTT 7 S13 TTCCCCCGCT 17 S451 GACAGGAGGT 8 S1211 GGGAAGACGG 18 S1037 CCTCACGTCC 9 S1301 ACCTAGGGGA 19 S1016 CAAGGTGGGT 10 S1209 GGGGTGTTCT 20 S1214 CTCACAGCAC -
将保藏的每代菌种培养成熟后用无菌水洗下再用150目无菌过滤网过滤,按5%的接种量接种于100 mL发酵培养基中,在温度30 °C,转速250 r/min的条件下发酵,每隔24 h进行取样。发酵液经超声波破碎细胞后,在4 °C、转速为2 000 r/min的条件下离心5min后提取上清液中的蛋白,每106细胞加250 μL RIPA裂解液(在使用前数分钟内加入蛋白酶抑制剂),混匀。然后进行SDS-PAGE电泳和考马斯亮蓝染色,得到胞内、胞外以及发酵液中总蛋白谱图。
-
本实验所有数据均采用软件SPSS Statistics 20.0进行方差分析(ANOVA),组间比较使用t检验,实验均重复3次,显著性水平:P˂0.05,差异性显著; P˂0.01,差异性极显著。
-
就定向进化而言,最常规、最简单的技术无疑是通过诱变产生多样性易错的PCR,而重离子诱变生物种源,由于传能线密度(LET)大,能在生物介质中产生高密度的电离、激发、能量和质量沉积,造成生物介质的损伤,易于产生突变体;损伤后修复效应小,可产生大量的突变且突变体稳定;相对生物学效应(RBE)高,因此突变体的产生效率高且突变谱广。因此,本研究使用80 MeV/u能量的重离子束12C6+,选取7个不同的辐照剂量,对黑曲霉进行辐照诱变,在各个辐照剂量下对黑曲霉的致死率进行比较,结果如表2。由表2数据可以看出,随着辐照剂量的增加,重离子束对黑曲霉的致死率呈上升的趋势;在辐照剂量为160 Gy时,黑曲霉的致死率就超过了80%;有文献报道,当菌株致死率超过80%发生正突变的几率高,因此可以确定选择该范围内诱变后的菌株作为主要的研究对象[27-28]。
表 2 重离子辐照黑曲霉的致死率
辐照剂量/Gy 对照 40 70 100 130 160 190 致死率/% 0 41.67 57.14 66.67 79.76 84.52 90.48 -
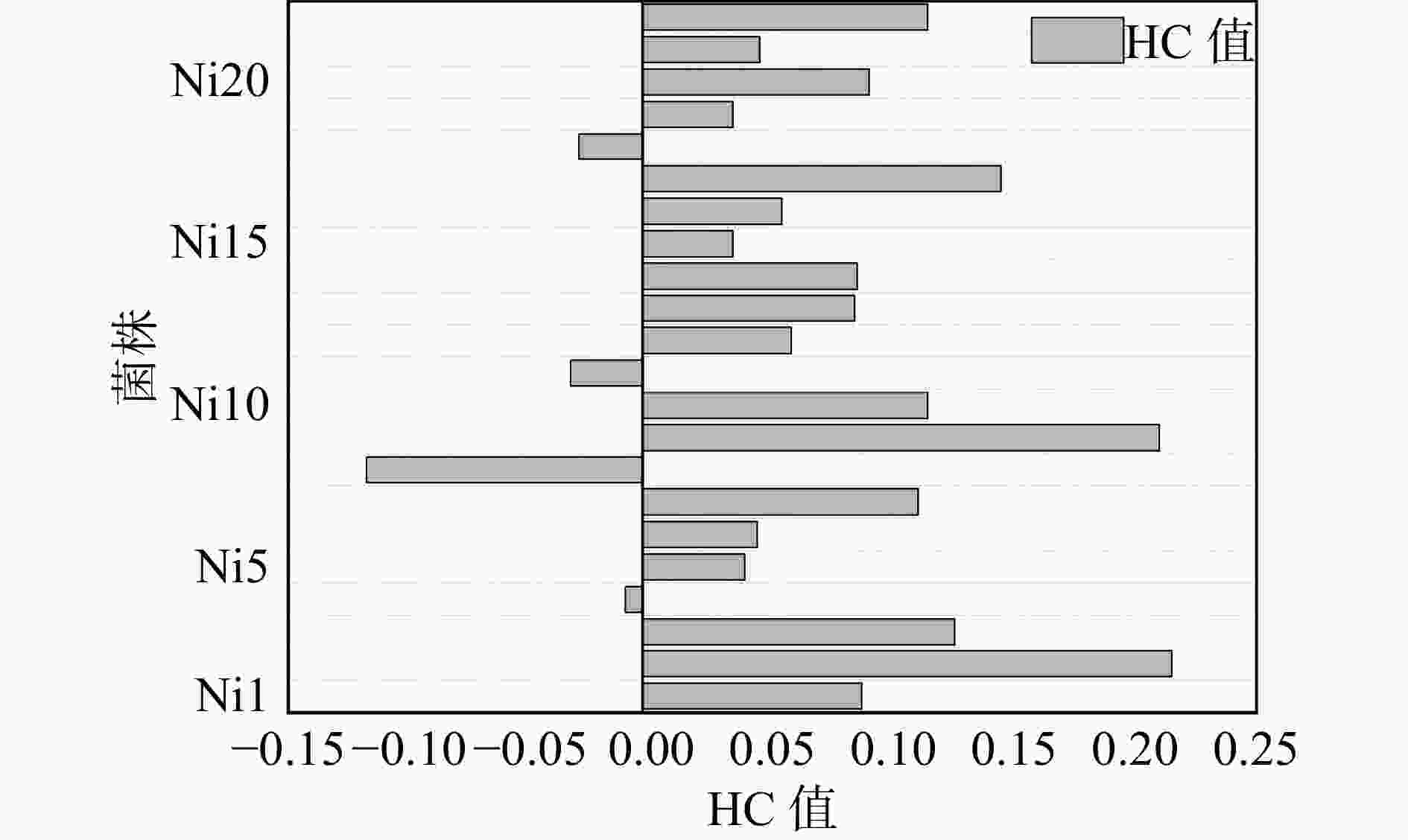
经过重离子12C6+辐照诱变之后,共得到22株突变菌株,菌株编号依次为Ni1-Ni22,于刚果红培养基上仔细划线接种,以确保出现单个菌落及变色圈,30 °C培养48 h 。变色圈直径与黑曲霉菌落直径的比值(HC值)为该菌性能大小的直观指标。刚果红可以跟作为大分子多糖的纤维素牢固结合,纤维素酶降解平板中的纤维素成小分子糖,而刚果红无法与小分子糖结合,则被洗脱下来,呈现透明圈。一般而言HC值大,则产量及性能较高;HC值小,则产量及性能较低。根据HC值的大小来选择优势黑曲霉菌,从而筛选突变体菌株。对辐照诱变后的单菌落进行平板初筛,计算各菌落的HC值,计算结果如图2所示。菌株的生长性能均发生较大改变,由于重离子辐照之后的突变具备不确定性,因此筛选的菌株存在正突变和负突变:其中4株的HC值为负值,性能明显低于原始菌株,其余菌株HC值都是正值,但有些菌株的变化不显著。在所有的正突变体中发现有两株Ni2和Ni9的菌株直径比原始菌株直径提高了20%,所以将这两株菌保存进行下一步研究。
-
进化的定向性如果假定为环境的一定性或一定的变化,则可用自然淘汰说加以说明,这种看法至今仍非常有说服力。微生物的突出特点之一是它们能够迅速适应各种环境条件,这种能力已被用于改进酵母菌株及不同的生物技术应用。构巢曲霉(Aspergillus nidulans)用于适应性进化的定向性中,导致其表型变化,同时使种群具备更高的适应度[29-30]。 然而,这种进化方法尚未应用于产生具有增强酶活的真菌菌株。
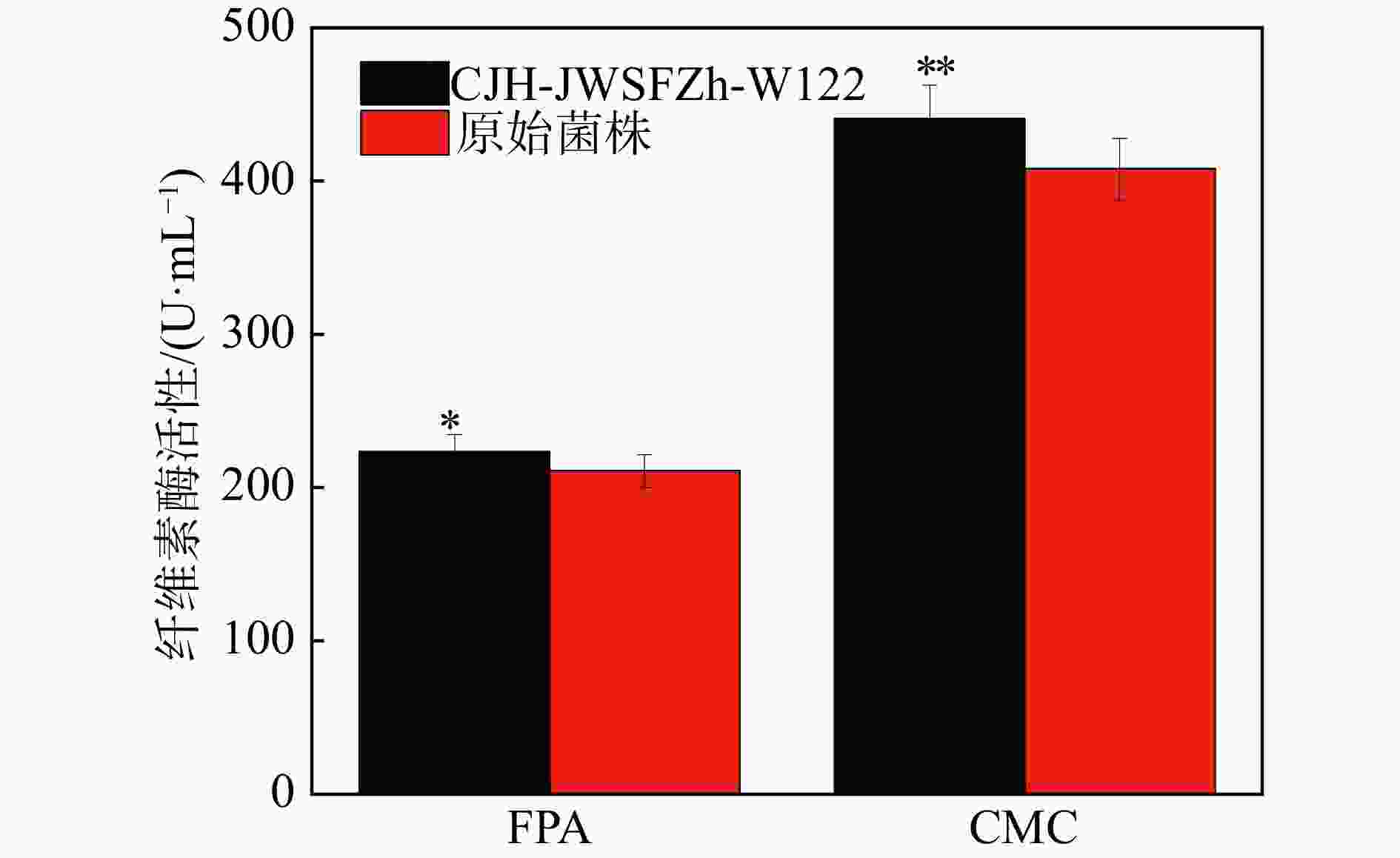
因此,本研究将初筛得到的两株优良菌株Ni2和Ni9进行了α-纤维素适应性进化定向性连续7代的培养后,将所得所有代数菌种摇瓶发酵,通过测定24 h最高纤维素酶活筛选出一株优良的突变菌株,命名为CJH-JWSFZh-W122。突变株CJH-JWSFZh-W122的FPA和CMC都显著高于原始菌株(如图3),与原始菌株相比,突变菌株CJH-JWSFZh-W122的FPA酶活达到了223.5 U/mL,比原始菌株的FPA酶活提高了6.07%(P=0.012˂0.05);CMC酶活达到了440.8 U/mL,比原始菌株的CMC酶活提高了8.01%(P=0.001˂0.01)。随后,对突变株CJH-JWSFZh-W122的酶活性随时间的变化进行研究,如图4所示,在整个发酵期间,突变菌株CJH-JWSFZh-W122在24 h时酶活性达到最大值,随着发酵时间的增加酶活性逐渐下降,72 h后酶活性不再变化,说明随着发酵时间的增加底物逐渐耗尽,菌株产酶能力下降,在发酵后期酶活性较稳定。
-
菌种的稳定性是影响工业菌株大规模发酵生产的关键因素之一。衰退是微生物细胞群体中由量变到质变逐步演化的过程。这与菌株基因的自发突变、传代次数、培养条件有关。菌种在移种传代过程中会发生自发突变。虽然自发突变的几率很低(一般为10−6~10−9),尤其是对于某一特定基因来说,突变频率更低。但是,由于微生物具有极高的代谢繁殖能力,随着传代次数增加,衰退细胞的数目就会不断增加,在数量上逐渐占优势,最终成为一株衰退了的菌株。为了研究突变菌株CJH-JWSFZh-W122的遗传稳定性,将突变菌株CJH-JWSFZh-W122进行斜面传代培养,成熟后进行摇瓶发酵,测定每代的滤纸酶活性。如图5所示:1代229.1 U/mL,2代220.3 U/mL,3代225.8 U/mL,4代232.2 U/mL,5代224.9 U/mL。W122的遗传性比较稳定,平均滤纸酶活性为223.5 U/mL。本研究测定了突变菌株CJH-JWSFZh-W122的遗传稳定性,将该菌株经过连续5次传代后仍然保持着优良的发酵性能,且测定其产生的纤维素酶依然保持着较高的活性,说明该菌株基因的自发突变率小,不受传代次数使负突变菌株逐渐占优势的影响,具有良好的遗传稳定性。
-
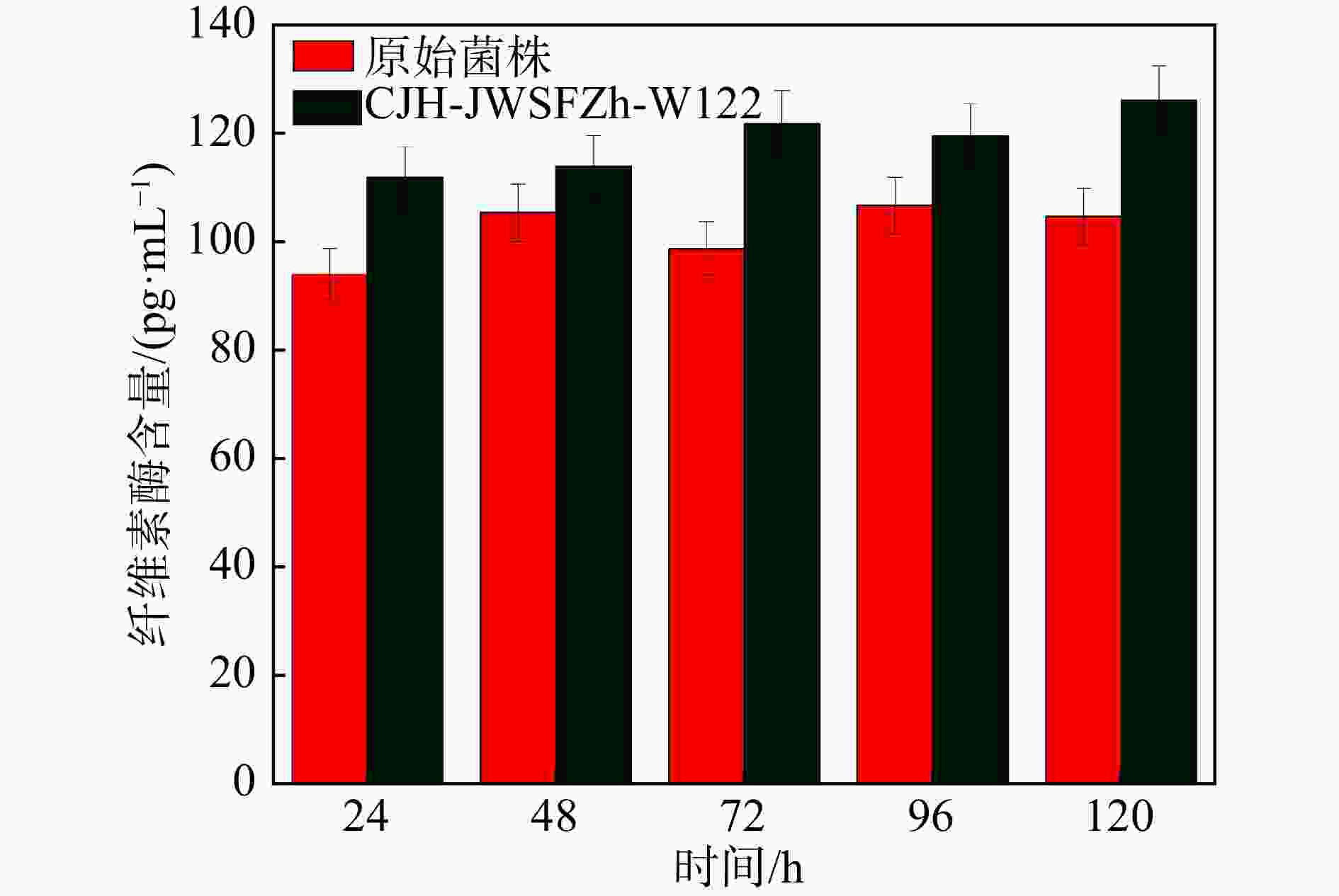
本文采用的重离子12C6+辐照结合适应性进化的定向性方法比单一经典重离子随机诱变更温和的方式更有效地改善了黑曲霉菌株性能,并得到突变菌株CJH-JWSFZh-W122,该方法在经过重离子辐照产生大量的随机突变菌株之后,结合适应性进化的定向性方法筛选出在纤维素环境中生产高纤维素酶的菌株。本文的实验结果证明了适应性进化的定向性作为一种技术工具,具有改善菌株产酶含量的实用性价值。如图6所示,原始菌株发酵48 h的纤维素酶含量最高,呈现先上升后下降的趋势,96 h之后酶含量逐渐稳定;突变菌株CJH-JWSFZh-W122的纤维素酶含量基本呈上升的趋势,并且都高于原始菌株的纤维素酶含量,发酵120 h时其纤维素酶含量比原始菌株提高了20.50%。但突变菌株CJH-JWSFZh-W122的酶活性在24 h达到最高,随后逐渐下降并保持平稳,这与纤维素酶含量的变化趋势不同。由于纤维素酶含量的变化是累加的过程,从图中可以看出,前24 h产生的纤维素酶最多,随后每天的酶增加量都在逐渐降低,说明从第2天开始产酶量逐渐减少。96 h时产酶量甚至低于失活的纤维素酶,随着纤维素酶活性降低,后续产酶量减少,总体的酶活性也同步降低,到72 h之后逐渐稳定。
-
根据RAPD谱带分析测定突变株CJH-JWSFZh-W122和原始菌株的变化(如图7)。结果显示,在Marker条带正常的对比条件下,原始菌株和突变株的DNA主带明显,纯度较高、完整性较好,没有拖尾和杂质出现。选取10条随机引物,对原始菌株和黑曲霉突变株CJH-JWSFZh-W122进行PCR扩增试验,扩增完成后对产物进行琼脂糖凝胶电泳分析。RAPD-PCR结果获得显著的多态性条带,如图7所示,随机引物S212、S1016和S1125、S25扩增黑曲霉原始菌株和黑曲霉突变株CJH-JWSFZh-W122的DNA后,其12个引物没有扩增条带,3个引物主条带不一致,5个引物主条带一致。造成差异的原因可能是重离子12C6+辐照后菌株的DNA发生部分损坏从而进一步影响了扩增结果。与黑曲霉原始株相比,突变株CJH-JWSFZh-W122与3条引物扩增后出现了变异特征条带,DNA基因组序列发生了变化。从DNA分子水平角度分析,重离子12C6+诱变可以导致菌株基因组DNA发生突变,由此可以得知,突变株CJH-JWSFZh-W122可以被认为是黑曲霉原始菌株经重离子12C6+辐照诱变后得到的突变株。
-
根据SDS-PAGE-考马斯亮蓝染色测定突变株CJH-JWSFZh-W122和原始菌株的蛋白变化(如图8、图9)。原始菌株的蛋白质24 h时和突变菌株相差不大,蛋白质检测均不明显。从48 h开始出现明显差异,突变菌株CJH-JWSFZh-W122蛋白分子量明显大于原始菌株,并且根据染色的颜色深浅程度,突变株相对原始菌株的颜色较深,所以其相同蛋白含量也比原始菌株更高, 特别是144 h之后差异更为明显,不论是不同分子量的蛋白种类还是相同分子量的蛋白含量,突变菌株都远远高于原始菌株。
据文献报道,对真菌中许多可用基因组的序列分析,仅确定了p67phox的同源物,称为noxR和Rac的同源物。为了确认黑曲霉中noxR在纤维素酶生产中的作用,在本研究中比较了突变株CJH-JWSFZh-W122 、敲除noxR突变体[31-32]及其原始菌株。在120 h的培养期间测量了突变菌株CJH-JWSFZh-W122与原始菌株的酶活性变化(图4)、纤维素酶含量变化(图6),结果显示突变株CJH-JWSFZh-W122具有较高的表达。在216 h的培养期间,突变株CJH-JWSFZh-W122和原始菌株的SDS-PAGE蛋白质条带改变强度方面显示出明显的差异,与文献中报道的不存在某些蛋白质的敲除noxR突变体相比,蛋白分子量的变化观察到类似的模式。在丝状真菌NADPH 氧化酶复合体中还有一些重要的调控亚基noxR和小GTPase Rac等,这些调控亚基参与noxA和noxB的调控作用[33]。noxR作为激活Nox1和Nox2两个亚单位所需的调节亚单位,noxR和Rac的功能研究表明noxR和Rac对Nox活化具有进化保守性[31,33]。这也证明了突变株CJH-JWSFZh-W122中noxR基因功能被激活并存在Nox异构体,尽管突变株CJH-JWSFZh-W122胞内蛋白浓度更高并显示出了较高的酶活性,然而Nox异构体如何在真菌黑曲霉中发挥不同的生物学作用仍有待探索。
此外,Takemoto等[34]描述了CDS Pa_7_11300编码这个被称为PaNoxR的假定p67phox同源物。数据库中存在两个覆盖PaNoxR的表达序列[35],微阵列数据表明PaNoxR在整个生命中都被转录循环,PaNox1和PaNox2也是如此。在存在碳源(
$ \alpha $ -纤维素)的环境中,PaNox1和PaNox2对$ \alpha $ -纤维素进行利用并负责调节纤维素降解。本研究采用重离子12C6+辐照结合适应性进化的定向性筛菌方法获得了黑曲霉突变菌株CJH-JWSFZh-W122,使其PaNoxR基因发生了突变,从而增强了其生产纤维素酶及降解纤维素的能力,PaNoxR的突变中存在高活性PaNox1, 2双突变体,PaNox2控制碳源,然后通过PaNox1调控酶的产生和分泌,然而高活性PaNox1, 2双突变体如何在$ \alpha $ -纤维素中发挥不同的协同作用仍有待进一步从代谢组学等多个角度研究,从而揭示其作用机理。 -
(1) 在12C6+离子束辐照诱变黑曲霉实验中,辐照剂量从40 Gy升至190 Gy时,黑曲霉的致死率从41.67%上升至90.48%,表明菌株的致死率随着辐照剂量的增大而增加,但是两者之间并没有明显的线性关系。
(2) 经过重离子12C6+辐照诱变之后,共得到22株突变菌株,其中两株的HC值大于0.2,将这两株菌进行适应性进化培养,所有代数菌株均进行摇瓶发酵,测定各代数菌株发酵24 h的纤维素酶活性,从而筛选出一株高产突变菌株CJH-JWSFZh-W122,其产纤维素酶的FPA酶活达到了223.491 8 U/mL,CMC酶活达到了440.838 5 U/mL,分别比原始菌株提高了6.09%和8.03%,表明重离子束12C6+诱变结合适应性进化对黑曲霉具有良好的诱变效果。
(3) 对突变菌株CJH-JWSFZh-W122进行遗传稳定性实验,结果表明,虽然在传代过程中菌株产生的纤维素酶活性存在一定的波动,但总体活性相对稳定,表明经过重离子12C6+辐照结合适应性进化得到的菌株遗传稳定性良好。
(4) 测定突变菌株CJH-JWSFZh-W122和原始菌株的纤维素酶含量,结果表明突变菌株的纤维素酶产量得到了大幅度提高,并且都在前24 h产酶量最多,此时酶活性也达到了最高值,随后酶产量虽然缓慢增加,但24 h之内增加的量都在逐渐减少,酶活性也随之逐渐降低,72 h之后趋于稳定。
(5) 根据相关文献的报道,结合理化分析及SDS-PAGE模式在蛋白质条带强度改变方面显示出的差异性,推断突变菌株中noxR基因功能被激活且PaNoxR基因发生了突变,可以得出重离子12C6+辐照结合适应性进化的定向性以更温和的方式有效地改造了黑曲霉菌株,从而增强了其生产纤维素酶及降解纤维素的功能。
因黑曲霉不产生毒素,糖化能力强,所以越来越受到工业界的青睐;同时黑曲霉作为新型饲料添加剂,在农业副产品和饲料工业中的应用也已相当普及。但是,该菌属类在降解木质纤维素方面依然存在降解效率低、酶产量低的瓶颈。本研究所采用的重离子12C6+辐照结合适应性进化的定向性(添加
$ \alpha $ -纤维素作为筛选条件)方法为筛选新的高效纤维素降解菌提供了一个新途径。本研究的相关结果为选育高效降解木质纤维素的菌种以及建立高效的木质纤维素生物降解体系奠定了理论基础,同时,也为最终实现纤维素类物质资源的快速转化及工业化生产提供了技术支撑。
Heavy Ion Irradiation Combined with Alpha-cellulose Adaptive Evolution to Improve Cellulase Activity of Aspergillus niger
-
摘要: 为获得可有效降解植物细胞壁中纤维素的高产纤维素酶菌株,将具有安全可靠、不产生毒素、生长速度快且发酵周期短等优势的黑曲霉作为出发菌株。利用重离子12C6+束流按照0 , 40 , 70 , 100 , 130 , 160, 190 Gy的辐照剂量对黑曲霉原始菌株进行辐照,经平板初筛后得到两株优良菌株;然后添加α-纤维素进行了8周自适应性进化,通过连续5代发酵该菌株生长性能稳定;将得到的每代菌株进行胞内蛋白分子量的对比,得到一株最优菌株CJH-JWSFZh-W122,将其摇瓶发酵测定纤维素酶活性,其产纤维素酶的滤纸酶活(FPA)到了223.5 U/mL,内切葡聚糖酶活(CMC)达到了440.8 U/mL,分别比原始菌株提高了6.07%和8.01%。突变株在连续5代发酵后仍保持了良好的发酵性能。对突变菌株CJH-JWSFZh-W122和原始菌株进行了RAPD分析和SDS-PAGE电泳分析,证实了该菌株存在基因突变。Abstract: In order to obtain high-yielding cellulase strains that can effectively degrade cellulose in plant cell walls, Aspergillus niger, which has the advantages of safety and reliability, non-toxicity, fast growth and short fermentation period, was used as the starting strain. The original strain, Aspergillus niger, was irradiated by heavy ion beam 12C6+ (irradiation doses: 40, 70, 100, 130, 160 and 190 Gy) , and two excellent strains were obtained after primary screening on the plate; 8 weeks of self-adaptive evolution, the strain has stable growth performance through 5 consecutive generations of fermentation; the obtained strains of each generation were compared for the molecular weight of intracellular proteins, and an optimal mutant strain CJH-JWSFZh-W122 was obtained, which was determined by shaking flask fermentation Cellulase activity, the filter paper activity(FPA) of cellulase production reached 223.5 U/mL, and the carboxymethyl cellulase activity(CMCase) reached 440.8 U/mL, which were 6.07% and 8.01% higher than the original strains, respectively. The excellent fermentation performance was still maintained after 5 consecutive generations; RAPD analysis and SDS-PAGE electrophoresis analysis were applied to compare the mutant strain CJH-JWSFZh-W122 and original strain, which confirmed the gene mutation of this strain.
-
Key words:
- Aspergillus niger /
- cellulase /
- heavy ion beam /
- alpha-cellulose /
- adaptive evolution
-
表 1 RAPD-PCR反应引物
编号 RAPD
引物编号5′-序列-3′编号 编号 RAPD
引物编号5′-序列-3′编号 1 S65 GATGACCGCC 11 S212 GGGTGTGTAG 2 S66 GAACGGACTC 12 S25 AGGGGTCTTG 3 S2160 CACCGACATC 13 S177 GGTGGTGATG 4 S2010 GGACGTTGAG 14 S1103 CTTCCCTGTG 5 S10 CTGCTGGGAC 15 S1121 ACTCCACGTC 6 S1404 GGCACGCGTT 16 S1125 GGGTGCAGTT 7 S13 TTCCCCCGCT 17 S451 GACAGGAGGT 8 S1211 GGGAAGACGG 18 S1037 CCTCACGTCC 9 S1301 ACCTAGGGGA 19 S1016 CAAGGTGGGT 10 S1209 GGGGTGTTCT 20 S1214 CTCACAGCAC 表 2 重离子辐照黑曲霉的致死率
辐照剂量/Gy 对照 40 70 100 130 160 190 致死率/% 0 41.67 57.14 66.67 79.76 84.52 90.48 -
[1] 付时雨. 中国造纸, 2019, 38(6): 54. doi: 10.11980/j.issn.0254-508X.2019.06.009 FU Shiyu. China Pulb & Paper, 2019, 38(6): 54. (in Chinese) doi: 10.11980/j.issn.0254-508X.2019.06.009 [2] 刘凯, 戴莉, 方诩, 等. 生物产业技术, 2014(3): 59. doi: 10.3969/j.issn.1674-0319.2014.03.008 LIU Kai, DAI Li, FANG Xu, et al. Bioindustry Technology, 2014(3): 59. (in Chinese) doi: 10.3969/j.issn.1674-0319.2014.03.008 [3] DAVIES G W, HENRISSAT K B. Biochemical Journal, 1997, 321(2): 557. doi: 10.1042/bj3210557 [4] VAISHNAV N, SINGH A, ADSUL M, et al. Bioresource Technology Reports, 2018, 2: 131. doi: 10.1016/j.biteb.2018.04.003 [5] SINGH A, BAJAR S, DEVI A, et al. Bioresource Technology Reports, 2021, 14: 100652. doi: 10.1016/j.biteb.2021.100652 [6] BUDIHAL S R, AGSAR D, PATIL S R. Bioresource Technology, 2016, 200: 706. doi: 10.1016/j.biortech.2015.10.098 [7] LV Y Y, ZHOU F, WANG B, et al. Biotechnology Letters, 2015, 37(3): 601. doi: 10.1007/s10529-014-1713-0 [8] LIN P J, SCHOLZ A, KRULL R. Biochemical Engineering Journal, 2010, 49(2): 213. doi: 10.1016/j.bej.2009.12.016 [9] WANG L, ZHANG J H, CAO Z L, et al. Microbial Cell Factories, 2015, 14(1): 7. doi: 10.1186/s12934-015-0190-z [10] VU V H, PHAM T A, KIM K. Mycobiology, 2011, 39(1): 20. doi: 10.1080/20786204.2014.10844583 [11] LIU K, LIN X J, LI X, et al. Bioresource Technology, 2010, 101(13): 4952. doi: 10.1016/j.biortech.2009.11.013 [12] RAGHUWANSHI S, DESWAL D, KARP M, et al. Fuel, 2014, 124: 183. doi: 10.1016/j.fuel.2014.01.107 [13] DONG M, WANG S, XIAO G, et al. Process Biochemistry, 2019, 84: 22. doi: 10.1016/j.procbio.2019.06.006 [14] 唐嘉徽, 杨富民, 王曙阳, 等. 甘肃农业大学学报, 2012, 3(47): 143. doi: 10.13432/j.cnki.jgsau.2012.03.008 TANG Jiahui, YANG Fumin, WANG Shuyang, et al. Journal of Gansu Agricultural University, 2012, 3(47): 143. (in Chinese) doi: 10.13432/j.cnki.jgsau.2012.03.008 [15] 周利斌. 重离子束辐照对植物组织培养及转基因操作的影响[D]. 北京: 中国科学院研究生院, 2006. ZHOU Libin. The Effect of Heavy Ion Beam Irradiation on Plant Tissue Culture and Genetic Modification[D]. Beijing: Graduate School of Chinese Academy of Sciences, 2006. (in Chinese) [16] 王光路, 王梦园, 刘兰茜, 等. 微生物学通报, 2022, 49(1): 306. doi: 10.13344/j.microbiol.china.210447 WANG Guanglu, WANG Mengyuan, LIU Lanqian, et al. Bulletin of Microbiology, 2022, 49(1): 306. (in Chinese) doi: 10.13344/j.microbiol.china.210447 [17] BACHMANN H, PRONK J T, KLEEREBEZEM M, et al. Current Opinion in Biotechnology, 2015, 32: 1. doi: 10.1016/j.copbio.2014.09.003 [18] KUTYNA D R, VARELA C, STANLEY G A, et al. Appl Microbiol Biotechnol, 2012, 93: 1175. doi: 10.1007/s00253-011-3622-7 [19] 王骏恺. 基于双因素理论视角的社交平台用户停用意愿研究[D]. 合肥: 中国科学技术大学, 2021. WANG Junkai. A Study on Social Platform Users' Willingness to Stop Using the Two-factor Theory [D]. Hefei: University of Science and Technology of China, 2021. (in Chinese) [20] KULKARNI S, HAQ S F, SAMANT S, et al. Probiotics and Antimicrobial Proteins, 2017, 10(4): 717. doi: 10.1007/s12602-017-9321-7 [21] 董妙音. 重离子束诱变选育高产长枝木霉菌株及其产纤维素酶机理和应用研究[D]. 兰州: 中国科学院大学(中国科学院近代物理研究所), 2021. DONG Miaoyin. Breeding of High-yielding Trichoderma Longbranchs Strains by Heavy Ion Beam Mutagenesis and Its Mechanism and Application of Cellulase Production [D]. Lanzhou: University of Chinese Academy of Sciences (Institute of Modern Physics, Chinese Academy of Sciences), 2021. (in Chinese) [22] PATYSHAKULIYEVA A, ARENTSHORST M, ALLIJN I E, et al. Biotechnology Letters, 2016, 38(6): 969. doi: 10.1007/s10529-016-2060-0 [23] ADNEY B, BAKER J. Pure and Applied Chemistry, 1996, 6: 1. doi: 10.1351/pac198759020257 [24] COLEMAN D J, STUDLER M J, NALEWAY J J. Analyticalbiochemistry, 2007, 371(2): 146. doi: 10.1016/j.ab.2007.08.027 [25] WU W, HILDEBRAND A, KASUGA T. et al. Enzyme Microb. Technol, 2013, 52: 184. doi: 10.1016/j.enzmictec.2012.12.010 [26] 陈光, 徐杨, 孙旸, 等. 吉林农业大学学报, 2011, 33(2): 177. doi: 10.13327/j.jjlau.2011.02.004 CHEN Guang, XU Yang, SUN Yang, et al. Journal of Jilin Agricultural University, 2011, 33(2): 177. (in Chinese) doi: 10.13327/j.jjlau.2011.02.004 [27] 麻和平, 彭章普, 张文齐, 等. 食品工业科技, 2021, 42(15): 139. doi: 10.13386/j.issn1002-0306.2021030234 MA Heping, PENG Zhangpu, ZHANG Wenqi, et al. Science and Technology of Food Industry, 2021, 42(15): 139. (in Chinese) doi: 10.13386/j.issn1002-0306.2021030234 [28] 韩鹏军, 李冰, 李书至, 等. 中国抗生素杂志, 2018, 43(8): 1031. doi: 10.13461/j.cnki.cja.006348 HAN Pengjun, LI Bing, LI Shuzhi, et al. Chinese Journal of Antibiotics, 2018, 43(8): 1031. (in Chinese) doi: 10.13461/j.cnki.cja.006348 [29] BROMANN K, TOIVARI M, VILJANEN K, et al. Applied Microbiology and Biotechnology, 2016, 100(14): 6345. doi: 10.1007/s00253-016-7517-5 [30] CHUNG D, UPADHYAY S, BOMER B, et al. Mycologia, 2015, 107(2): 298. doi: 10.3852/14-079 [31] MIN J K, MARK A, EELKE D, et al. Molecular Microbiology, 2011, 79(5): 1151. doi: 10.1111/j.1365-2958.2010.07524.x [32] STEIGER M G, MACH R L, MACH-AIGNER A R, et al. J Biotechnol, 2010, 145: 30. doi: 10.1016/j.jbiotec.2009.10.012 [33] TUDZYNSKI P, HELLER J, SIEGMUND U. Current Opinion Microbiol, 2012, 15(653). doi: 10.1016/j.mib.2012.10.002 [34] TAKEMOTO D, TANAKA A, SCOTT, B. Fung Genet Biol, 2007, 44: 1065. doi: 10.1016/j.fgb.2007.04.011 [35] ESPAGNE E, LESPINET O, MALAGNAC F, et al. Genome Biol, 2008, 9: R77. doi: 10.1186/gb-2008-9-5-r77 -




 下载:
下载:















 甘公网安备 62010202000723号
甘公网安备 62010202000723号